于肖飞教授团队揭示增强实体瘤免疫敏感性的全新靶基因
T细胞免疫反应是人体清除肿瘤细胞的关键机制,它通过识别肿瘤细胞表面的MHC分子进而杀伤肿瘤细胞【1】。但肿瘤细胞具有多种机制逃逸免疫监视,限制T细胞的杀伤功能,其中包括降低抗原呈递、形成抑制性免疫微环境等【2】,这些机制同时也是影响免疫检查点抑制剂(ICB)疗法的关键因素。胰腺癌作为代表性的“冷肿瘤”,由于肿瘤细胞的低突变负荷、低抗原递呈的特点,阻碍了T细胞浸润与激活,导致其对免疫疗法响应较差【3-5】。因此,寻找新的靶点进而增强免疫治疗效果,延长患者生存期,具有极其重要的意义。
2024年11月15日,复旦大学生命科学学院教授、复旦大学张江研究院双聘人员于肖飞团队在Journal of Experimental Medicine发表了题为MCRS1 sensitizes T cell-dependent immunotherapy by augmenting MHC-I expression in solid tumors的研究论文。该研究从胰腺癌出发,揭示了MCRS1在实体瘤中能够通过上调MHC-I分子表达,增强肿瘤细胞对T细胞杀伤的敏感性,同时改善PD-1阻断疗法的治疗效果。


研究团队利用CRISPR激活(CRISPRa)筛选技术,在小鼠胰腺癌细胞(HT)中进行单基因扰动和体外杀伤筛选,并结合TCGA数据库及胰腺癌临床病理样本分析,鉴定出Mcrs1这一能够增强HT细胞对杀伤敏感性的候选基因。通过体内外实验发现,Mcrs1高表达可提高肿瘤细胞中MHC-I分子的表达水平和肿瘤浸润性T淋巴细胞的激活。通过ChIP-Seq、IP-MS及ATAC-Seq分析,发现MCRS1结合于MHC-I基因座,并与另一转录因子YY1相互作用进而协同调控染色质可及性和MHC-I的表达(图1)。同时,Mcrs1高表达也可以增强PD-1阻断对小鼠胰腺癌的治疗效果。临床数据分析表明,MCRS1高表达与胰腺癌患者总生存时间呈正相关。在非小细胞肺癌患者中, MCRS1高表达的患者同样也展现出了更好的PD-1阻断的治疗效果,这表明MCRS1可能在多种实体瘤中都具有相似的免疫增敏效果,具有作为临床中预测PD-1阻断治疗疗效的新指标的潜力。
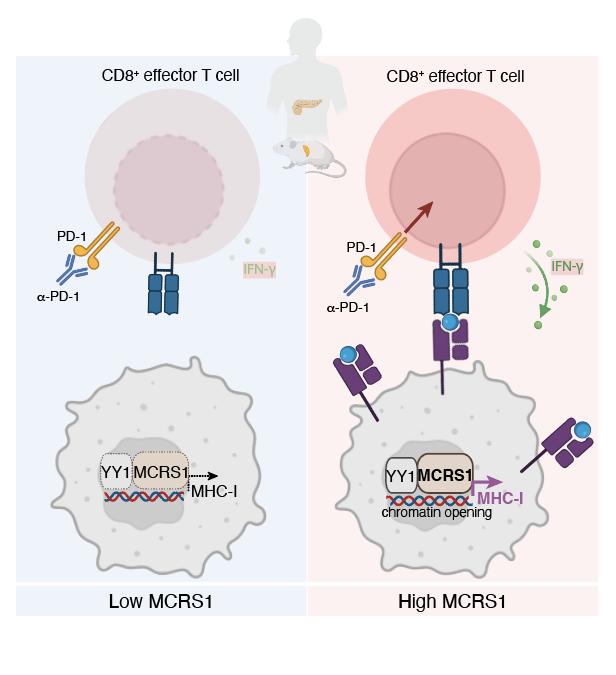
综上所述,该研究阐明了MCRS1调控肿瘤MHC-I表达的全新机制,MCRS1高表达的免疫增敏效应可以提高ICB的治疗效果,实现了肿瘤的由“冷”转“热”,为增强肿瘤免疫治疗效果提供了新靶点与新思路。
复旦大学生命科学学院、遗传工程国家重点实验室、复旦大学张江研究院于肖飞研究员为最后通讯作者,海军军医大学第一附属医院刘艳芳副教授为共同通讯作者,并得到呼吸与危重症医学科董宇超主任的大力支持。复旦大学生命科学学院博士后李雪、博士生依含、金哲宇,硕士生蒋凯韬同学为该论文的共同第一作者。

于肖飞,复旦大学生命科学学院青年研究员博士导师、复旦大学张江研究院双聘教授。主要从事肿瘤微环境对T淋巴细胞的抑制机制及增强T淋巴细胞抗肿瘤活性的基因工程改造。于肖飞研究员于2020 年作为PI引进到复旦大学张江研究院,在研究院双聘期间,凭借“胰腺癌免疫治疗增效靶点的筛选及其机制研究”项目,入围2020年上海市自然科学基金探索类项目。
参考文献:
1. Mellman, I., et al., The cancer-immunity cycle: Indication, genotype, and immunotype. Immunity, 2023. 56(10): p. 2188-2205.2. Fenis, A., et al., New immune cell engagers for cancer immunotherapy. Nat Rev Immunol, 2024. 24(7): p. 471-486.3. Yamamoto, K., et al., Autophagy promotes immune evasion of pancreatic cancer by degrading MHC-I. Nature, 2020. 581(7806): p. 100-105.4. Zhong, W., et al., Comparison of the molecular and cellular phenotypes of common mouse syngeneic models with human tumors. BMC Genomics, 2020. 21(1): p. 2.5. Maleki Vareki, S., High and low mutational burden tumors versus immunologically hot and cold tumors and response to immune checkpoint inhibitors. J Immunother Cancer, 2018. 6(1): p. 157.





